据国家癌症中心最新发布的2019年全国癌症统计数据显示,中国恶性肿瘤每年发病约392.9万人,死亡约233.8万人,也就是每分钟有7.5人被确诊为癌症。
在谈癌色变的今天,我们应认识到:治愈癌症的关键在于更好地了解癌症。
在传统抗癌方法遭遇瓶颈后,免疫疗法横空出世,为我们带来新希望,然而免疫疗法也不是万能的,免疫应答率低导致病患治疗效果不理想。这时候“万能的”人工智能来了,它将如何助力免疫疗法更好地抗癌?
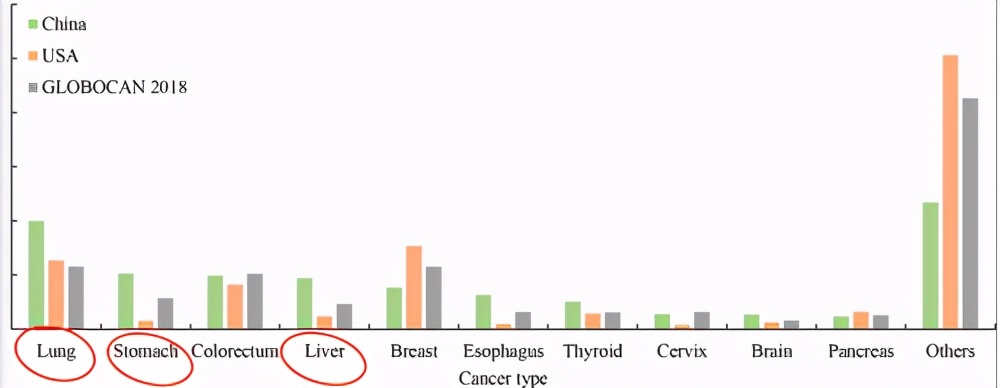
中国常见癌症类型的百分比及其在美国和全球的相应比例。Cao, Maomao, et al. Cancer Communications 40.5 (2020): 205-210.
传统癌症疗法 VS 时髦的免疫疗法
癌症种类有上百种,但从本质上讲,癌症都是由细胞不受控制地疯狂增长造成的。而造成细胞恶性增长主要是细胞中的遗传物质突变和身体免疫功能降低的综合后果。
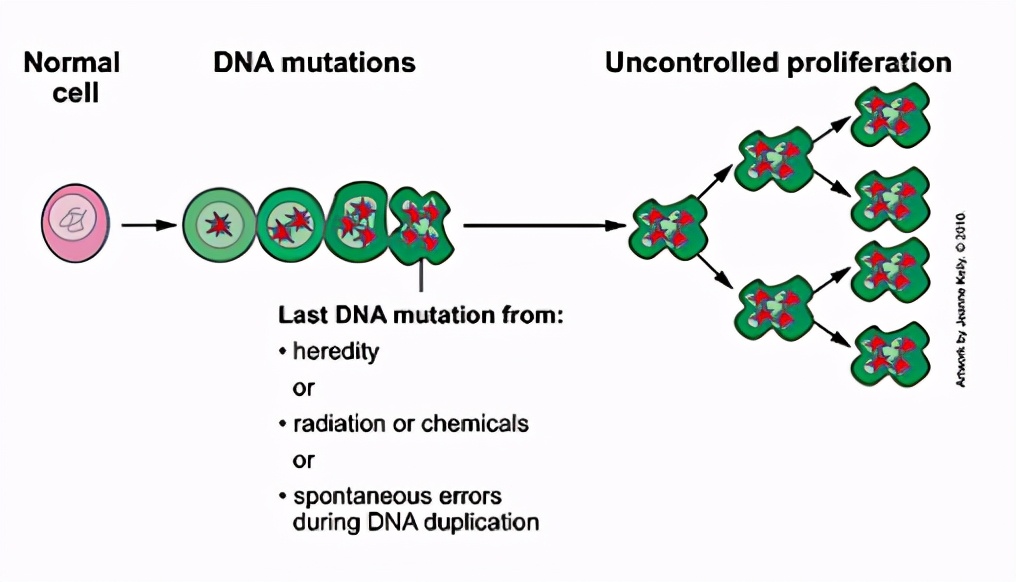
图片来源National Cancer Institute
有人可能会问,DNA突变是怎么能导致癌变呢?
首先我们了解下正常细胞怎么处理DNA突变的。其实DNA在日常生活中受到的挑战,要比我们想象的艰难得多。以DNA复制为例,人体约有40~60万亿个细胞,每个细胞都含有近30亿个碱基长度的DNA。我们都是从单细胞——受精卵分裂而来,每次的细胞分裂要把全部DNA复制一遍。如何将这30亿个“字”抄写一遍又一遍,同时又保证不出错,本身就极具挑战。
好在细胞有强大的一套系统来识别、纠正错误,比如抑癌基因P53会被多种错误激发,然后调控细胞适当放慢DNA复制速度,给细胞更多时间来纠错。当错误比较严重、无可救药时,P53可以开启细胞凋亡(apoptosis),从而把坏细胞清除掉,避免拥有错误的细胞继续分裂生长。
然而,如果运气不好,突变发生在P53基因上,就有可能导致细胞“刹车”失灵,无法有效纠错,坏细胞恶性生长分裂,从而导致癌变。除了P53基因, 其他控制细胞增殖的关键基因如果发生突变,也会导致细胞过度增殖产生癌变。
除了DNA复制自发产生突变,日常生活中有很多因素也可以诱发DNA变异,包括香烟中的苯并芘(BαP),中草药中的马兜铃酸,紫外线辐射以及病毒感染等。DNA变异的次数越多,基因突变的机会也就越大,也就越有可能导致癌症,这也是为什么健康生活习惯可以降低癌症发病率的原因。
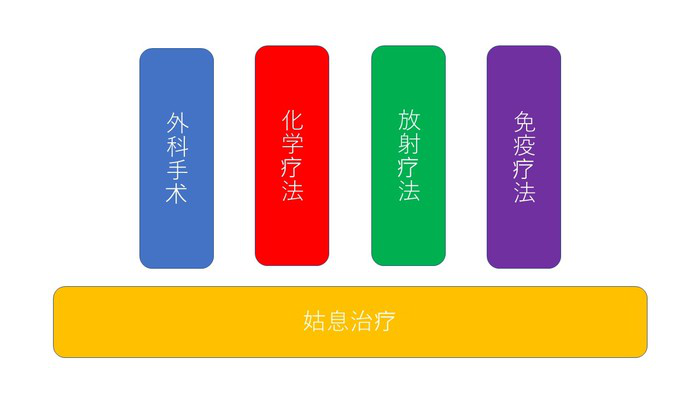
癌症治疗的分类,图片来自http://www.jspm.ne.jp
医生和科学家在努力治疗这些失控癌细胞身上费尽了心思。比如,大家经常听说的外科手术、化学疗法、放射疗法等。
但这些传统疗法都有一定的缺陷,放化疗存在“杀敌一千,自损八百”的问题,因为无论是化学药物,还是物理射线都不能很好地识别哪些是癌细胞,哪些是健康细胞,从而伴随着比较大的副作用,如何提高化疗药物定点传送一直是业内难题,靶点药物具有较好的特异性,但因为癌细胞突变率较高,很容易产生新突变对药物产生抗性。
免疫疗法是癌症治疗的重大突破。与传统方法不同的是,免疫疗法并不是想尽办法直接杀死癌细胞,而是通过调节身体的免疫系统来间接杀死癌细胞。
为啥免疫治疗有这样的优势?因为免疫系统经过长年的进化,有能力特异识别癌细胞,同时与病人的身体本身有很好的兼容性,副作用相对较小,这就相当于四两拨千斤,用自然之力来治疗癌症。
或许以上说法太抽象?打个比方,相信大家都看过《生化危机》,癌细胞就像那些受到感染突变的丧尸,当地军队能力有限,不能控制丧尸扩散。传统疗法就相当于哪里有丧尸,哪里就进行大规模轰炸,在杀死丧尸的时候,同时也杀死了平民和百姓,也就是正常细胞。而免疫疗法就像给军队提升武器装备,军队有很好的能力识别谁是平民谁是丧尸,又有高效的武器,因此能精准地杀死癌细胞。
谈到肿瘤免疫治疗,我们知多少?
但你可能会问,既然免疫系统本身这么厉害,癌症发生的时候,它干啥去了?“不是我军太无能,而是敌人太强大。”事实上,不是免疫系统偷懒,而是癌细胞太狡猾,用多种方法来抑制免疫系统,逃过免疫系统的监察。
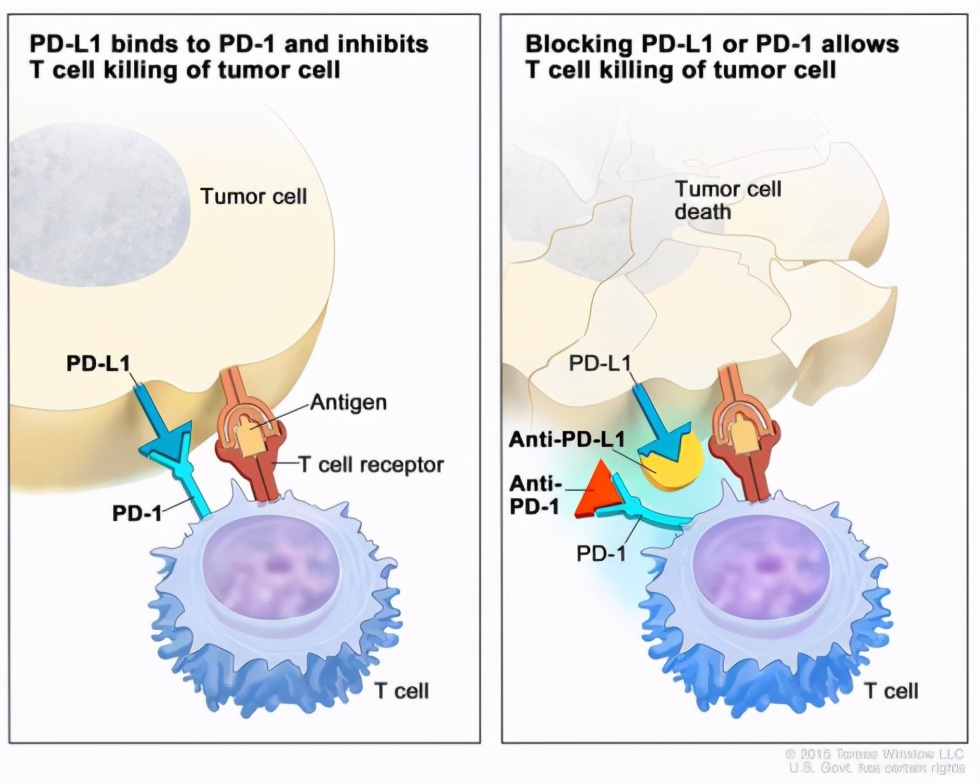
癌细胞关停免疫T细胞 应答的机制:PD-L1与PD-1的结合阻止T细胞杀死体内的肿瘤细胞(左图)。用免疫检查点抑制剂(anti-PD-L1或 anti-PD-1)阻断PD-L1与PD-1的结合,可以使T细胞杀死肿瘤细胞(右图)。图片来源:NIH National Cancer Institute
01免疫疗法1:免疫检查点抑制剂(
癌细胞存在多种方式逃逸免疫系统,包括PD-1 / PD-L1和CTLA-4 / B7-1 / B7-2。免疫细胞表面存在一种免疫检查点蛋白,如PD-1,它与细胞程序死亡-配体1(PD-L1)结合,可以传导抑制性的信号,减低免疫CD8+ T细胞的增生,从而防止免疫反应过强。
但是有时也会被癌细胞“不当利用”,如图中所示,癌细胞用该方式来抑制免疫细胞应答,现在有药物来抑制PD-1/PD-L1的特异性结合,就可以防止癌细胞“关停”免疫应答,从而消灭癌细胞。可喜的是,FDA已经批准多种此类药物,包括nivolumab(抗PD-1)、atezolizumab(抗PD-L1)等。
02免疫疗法2:CAR-T细胞免疫疗法(
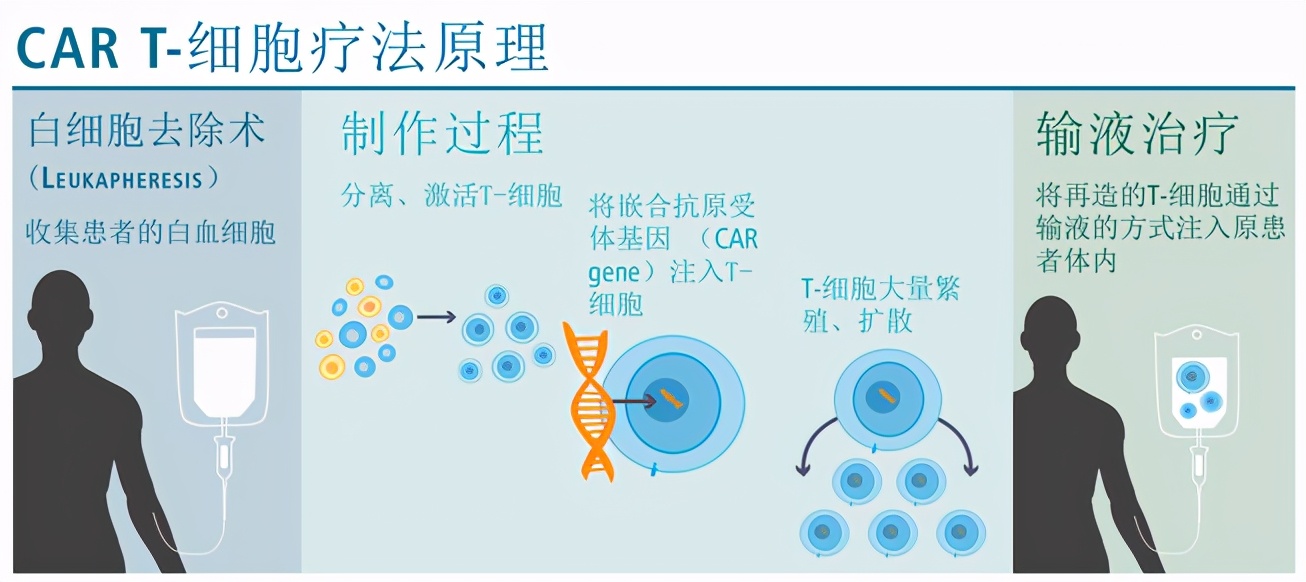
图片来源Dana-Farber Cancer Institute
CAR-T细胞(Chimeric Antigen Receptor T-Cell)是免疫疗法的另外一大利器,经过基因工程改造人体的免疫CAR-T细胞,可大幅度提升其“战斗能力”,包括靶向性、杀伤活性和持久性。CAR-T细胞免疫疗法中的T细胞是从患者本身的外周血采集,在体外利用基因工程给T细胞加入一个既能识别肿瘤细胞,又能激活T细胞靶向杀死肿瘤细胞的嵌合抗体,在体外大规模培养后,再输回患者本身,从而提高免疫能力。我们再用“丧尸”做比方,CAR-T细胞免疫疗法相当于给把当地的“军队”调出来特别训练,升级武器,再送回去消灭“丧尸”。
除了以上的免疫检查点抑制剂和免疫细胞治疗外,肿瘤细胞免疫疗法包括细胞因子治疗、基因治疗、靶向治疗、肿瘤疫苗等,但需要再次强调的是,所有免疫疗法的核心都是通过调节自身的细胞免疫应答,从而间接消灭癌细胞。
人工智能如何助力免疫疗法
尽管肿瘤免疫疗法前途一片光明,但仍存在众多挑战。比如不同患者对免疫治疗剂反应差别较大,原因未知,并且这些疗法目前尚无可靠的疗效预测指标,对于个体来说,治疗前很难知道有无疗效,这些疗法还往往很贵,比如国内的CAR-T细胞免疫疗法估计20万元起步。
此外,由于免疫疗法调高了免疫系统应答,可能引起过度免疫反应,存在副作用,而且癌细胞突变多,每个人甚至每个组织的癌细胞都不一样,如何针对下药,是免疫治疗成功的关键。
人工智能助力癌症免疫疗法,图片来自Acta Pharmaceutica Sinica B (2021).
对于这些难题,人工智能的飞速发展为解决这些难题提供了一种新颖的思路。通过机器学习对大量已有的癌症临床数据进行训练,包括组织切片图像、测序数据、临床数据等,不断地强化学习,可以在大数据中找到深层的潜在规律,从而对免疫疗法进行更加精准的建议和预判,将成功概率最大化,副作用最小化。
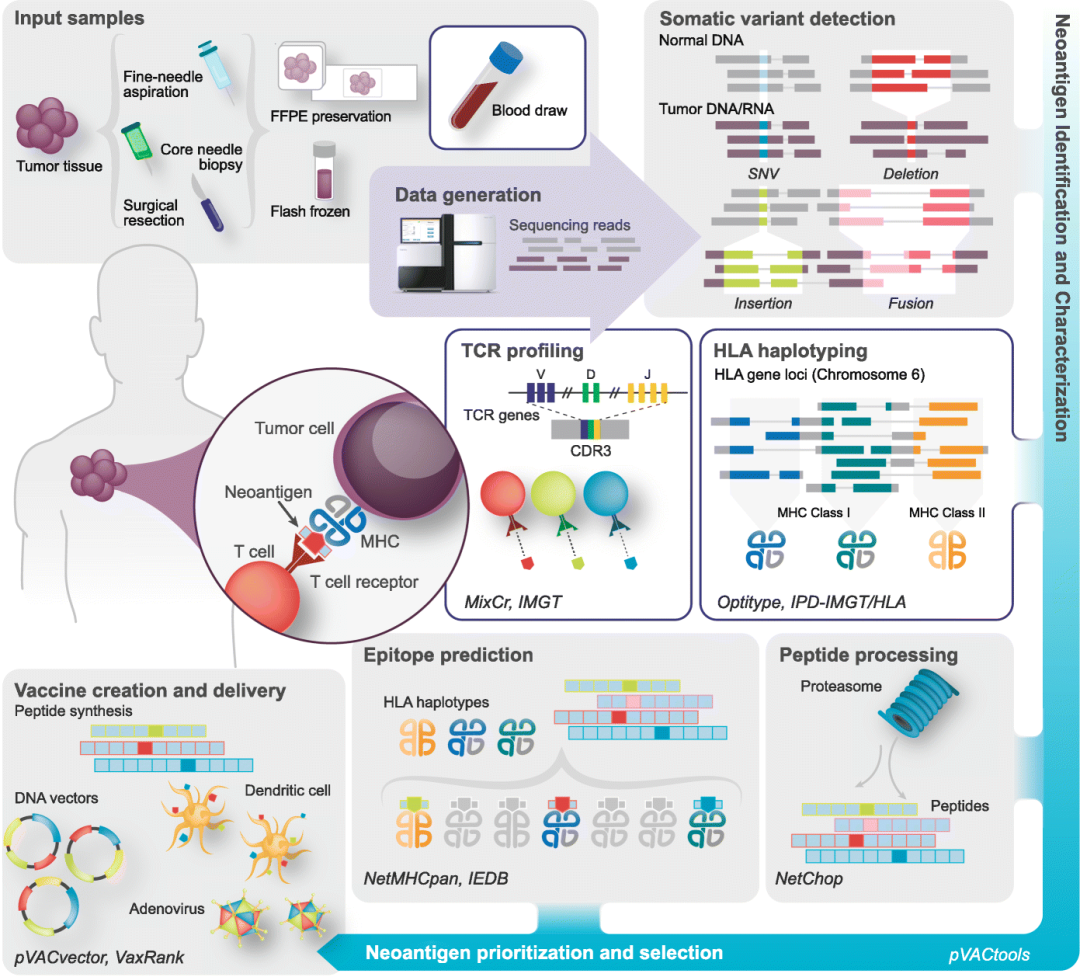
利用人工智能预测肿瘤细胞表面新抗原,Richters, Megan M., et al. Genome medicine 11.1 (2019): 1-21.
免疫细胞之所以能特异识别癌细胞,是因为癌细胞表面有特定的抗原“标记”。而不同的肿瘤细胞可以产生不同的抗原,如何特异地分辨这些抗原,创建个性化免疫治疗方案,是免疫疗法的关键和难题之一。
最近,青年企业家黄峥及其团队设立的繁星公益基金宣布,将在未来3-5年向浙江大学教育基金会捐助1亿美元,用于支持公益性科研,其中“肿瘤免疫新抗原研究”攻关正是首批重点项目之一。
事实上,在人工智能的帮助下,研究人员和临床医生已利用下一代测序技术来鉴定新抗原,并创建用于癌症治疗的个性化免疫疗法。简单而言,要首先收取病人组织样本,进行处理以及高通量测序,然后检测各种类型的体细胞变异体,预测表面的新抗原结构,分析患者序列以确定人类白细胞抗原(HLA)类型,最后设计个性化的癌症疫苗:从匹配的肿瘤正常测序数据中对新抗原进行计算预测,然后根据其在刺激T细胞反应中的预测能力对其进行排名,从而择优选取。该候选新抗原预测过程涉及多个步骤,包括体细胞突变鉴定、HLA分型、肽加工和肽-MHC结合预测,每个步骤的分析和预测都有机器学习的应用。
人工智能除了可以帮助我们找到癌细胞表面的抗原之外,还可以助力认识不同癌细胞的其他独特特征,尤其是随着基因组、转录组大规模测序的普及,甚至是单细胞测序技术的发展,生物医学中产生了越来越多的数据,通过机器学习对这些数据的分析,很有可能找到其他特征。比如Reiman等人利用神经网络模型,通过在临床环境中整合RNA-Seq和成像数据,准确表征了大肠、乳腺、肺和胰腺实体瘤的肿瘤免疫微环境,这对决定患者癌症免疫疗法的反应至关重要。对于前面提到的不同患者对免疫治疗反应差别较大,也通过人工智能对基因组突变、转录组等数据的分析,找到不同个体产生差异的原因,从而为以后治疗方式提供借鉴。
目前,已有研究将人工智能应用于癌症免疫治疗中的类似任务,如研究人员使用人工智能软件对一种名为“电子鼻”或“ eNose”的设备进行了培训,可以精确预测NSCLC患者是否会对抗PD-1治疗产生反应。
未来面对的挑战
尽管人工智能在癌症免疫疗法中具有很大的潜力,但将人工智能大规模运用到免疫治疗中仍面临许多障碍。从大量数据中学习,识别其中我们觉察不到的规律是人工智能最大的优势,但另一方面,数据量不足是限制人工智能效果的主要原因之一,尤其是考虑到目前很少有公共数据库可用。
由于各种原因,如商业目的不统一或与个人隐私法有关,一些利益相关者不愿彼此交换数据。因此,我们鼓励全国乃至世界各地的医院和研究所之间共享数据,这对提高人工智能方法准确性至关重要。另一方面,机器学习模型就像一个“黑匣子”,它是看不见的,从而导致临床专家对它们不信任,因此确定人工智能分析结果的准确性,也至关重要。
参考文献
1. Cao, Maomao, et al. “Cancer burden of major cancers in China: A need for sustainable actions.” Cancer Communications 40.5 (2020): 205-210.
2. Morrissey, Kari M., et al. “Immunotherapy and novel combinations in oncology: current landscape, challenges, and opportunities.” Clinical and translational science 9.2 (2016): 89-104.
3. Xu, Zhijie, et al. “Applying artificial intelligence for cancer immunotherapy.” Acta Pharmaceutica Sinica B (2021).
4. Richters, Megan M., et al. “Best practices for bioinformatic characterization of neoantigens for clinical utility.” Genome medicine 11.1 (2019): 1-21.
5. https://training.seer.cancer.gov/disease/history/
 iNews新知科技 关注科技,自有新知
iNews新知科技 关注科技,自有新知

